Это позволит ускорить оптимизацию прототипов до молекул-кандидатов для последующих доклинических испытаний.
Поиск новых лекарственных молекул с заранее заданными свойствами довольно сложный, дорогостоящий и времязатратный процесс, особенно в онкологии. Современная наука позволяет ускорить этот поиск посредством применения компьютерных технологий и внедрения автоматизированных процессов. В разработке биологически активных молекул выделяют два основных понятия – лекарственная молекула и терапевтическая мишень.
Молекула связывается с мишенью, чаще всего белком, тем самым воздействуя на определённые клеточные функции. Если терапевтическая мишень известна, то первым этапом дизайна нового лекарства является поиск малых молекул, способных взаимодействовать с мишенью. Отбор молекул проводится из огромных виртуальных химических библиотек, включающих миллионы соединений.
В последнее десятилетие процесс отбора потенциальных лекарственных молекул был значительно упрощён благодаря внедрению роботизированного высокопроизводительного скрининга (High-Throughput Screening), позволяющего в короткие сроки тестировать тысячи соединений.
Соединения-прототипы, прошедшие отбор в ходе высокопроизводительного скрининга, хоть и способны взаимодействовать с интересующим белком, тем не менее, еще далеки от конечного лекарства и не могут сразу быть использованы в доклинических и клинических испытаниях.
Для начала доклинических исследований биологически активные молекулы должны отвечать ряду критериев, таких как высокая активность по отношению к белку-мишени, отсутствие воздействия на другие мишени, а также хорошая фармакокинетика, т.е. способность молекулы попадать, распределяться и выводиться из организма и не оказывать на него токсического действия. Чтобы найти молекулу, удовлетворяющую всем необходимым критериям, соединения-прототипы проходят этап оптимизации, который также является достаточно дорогостоящим и трудоёмким.
По словам заведующего кафедрой органической химии Университета Лобачевского, профессора РАН Алексея Федорова, исследовательской группой была разработана стратегия, позволяющая значительно ускорить и автоматизировать процесс оптимизации прототипов до молекул-кандидатов для последующих доклинических испытаний.
«Данный подход объединяет дизайн химической библиотеки, ориентированной на интересующую терапевтическую мишень, виртуальный (компьютерный) скрининг полученной библиотеки, а также автоматизированный синтез и исследование биологической активности полученных молекул in vitro (в пробирке)», – отмечает Алексей Федоров.
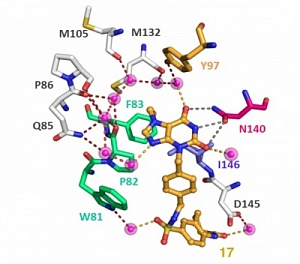
На первой стадии разработанного подхода определяется модель взаимодействия выбранной молекулы-прототипа с мишенью с помощью рентгеноструктурного анализа. Затем на основании полученных данных проводится дизайн новой виртуальной химической библиотеки. При этом молекула-прототип является главным строительным блоком, к которому добавляются новые компоненты, соответствующие строению белка-мишени.
Для объединения строительных блоков в новые молекулы используются тщательно подобранные химические реакции, соответствующие требованиям медицинской химии. Отбор химических реакций гарантирует, что соединения новой химической библиотеки могут быть легко получены методами органической химии в одну или две стадии с высокими выходами и без побочных продуктов. На следующем этапе проводится компьютерный скрининг полученной виртуальной библиотеки с целью выбора молекул с оптимальным взаимодействием с мишенью, а также необходимыми заданными свойствами, такими как растворимость, биодоступность, токсичность и др. Всё это значительно повышает шансы нахождения потенциального кандидата на роль лекарственной молекулы.
И, наконец, соединения, отобранные в ходе компьютерного скрининга, синтезируются, а их биологические свойства тестируются in vitro. Оба этих процесса в настоящее время могут быть полностью роботизированы и автоматизированы, что значительно сокращает время разработки новых лекарственных соединений.
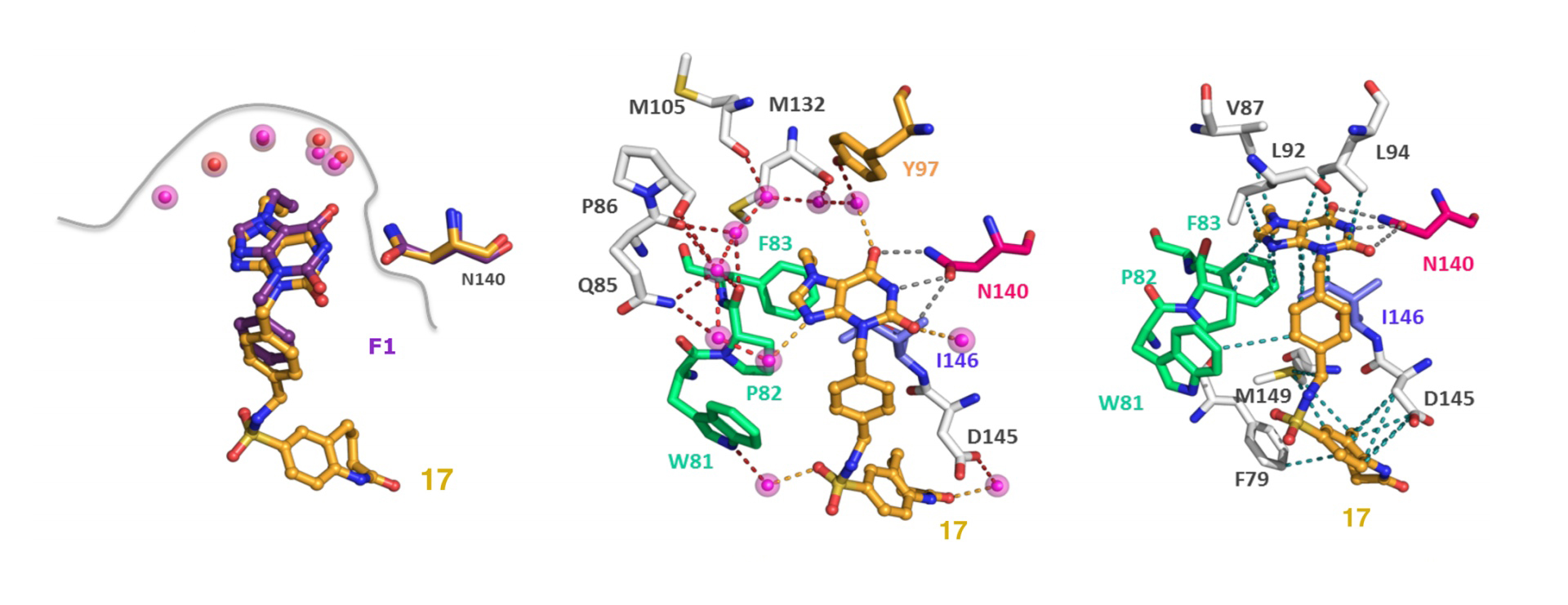
Эффективность предложенной нами стратегии была показана на примере оптимизации противоопухолевых веществ – ингибиторов бромодомен-содержащих белков. Этот класс белков вовлечён в регуляцию ряда генов, играющих ключевую роль в развитии рака.
«Ранее нашей группой была идентифицирована молекула-прототип, способная эффективно взаимодействовать с данной терапевтической мишенью. Оптимизация прототипа с использованием описанной методики позволила получить несколько молекул-кандидатов, которые более чем в 60 раз лучше связывались с мишенью, демонстрировали улучшенную селективность, водорастворимость, а также эффективность в клеточных тестах. В настоящий момент идёт подготовка полученных молекул к доклиническим испытаниям для лечения различных типов опухолей», – подводит итог профессор Федоров.
В настоящее время направленное конструирование новых лекарственных молекул стало важнейшей частью фармакологии. Переход от метода проб и ошибок к действительно рациональному дизайну лекарств, достигаемому за счёт внедрения в медицинскую химию компьютерных и роботизированных подходов, открывает путь к более эффективному и быстрому получению новых лекарственных молекул с желаемыми физико-химическими свойствами и биологическим действием.
Источник: Официальный сайт ННГУ им. Н.И. Лобачевского